Le syndrome d’embolie graisseuse post traumatique: diagnostic et prise en charge, à propos d’un cas et revue de la littérature.
Joseph KONE1, Mamadou Karim TOURE 1, Mahamadoun COULIBALY 1, Siriman A KOITA1, Terna TRAORE2, Boubacar DOUMBOUYA2, Mamadou Salia DIARRA3, Saoudatou TALL4, Diénéba DOUMBIA5.
1. Service d’Anesthésie Réanimation- Hôpital Mère-Enfant «le Luxembourg», 2. Service d’Orthopédie Traumatologie- Hôpital Mère-Enfant «le Luxembourg», 3. Service de Neurochirurgie Hôpital Mère-Enfant «le Luxembourg», 4. Service de Gynécologie-obstétrique CSREF- CV, 5. Service d’Anesthésie Réanimation Urgences – CHU du Point G.
L’objectif de cet article était de rappeler la problématique du diagnostic et de la prise en charge du syndrome d’embolie graisseuse post-traumatique. Le syndrome d'embolie graisseuse (SEG) est un ensemble de manifestations pulmonaires et systémiques secondaire à l'obstruction des petits vaisseaux par des particules graisseuses. La physiopathologie est mal connue et repose sur deux théories dont la plus répandue est celle de Gauss. La première description du syndrome d’embolie graisseuse a été faite par Von Bergman en 1873. Son incidence varierait de 0,5 à 30% dans les suites de fractures osseuses. Des étiologies non traumatiques ont été citées dans la littérature. Le diagnostic positif est évoqué devant une notion de traumatisme des os longs associée à des signes cliniques, radiologiques et biologiques évocateurs. Le tableau classique est constitué de la triade de Gurd regroupant des manifestations cutanées, respiratoires et neurologiques. A défaut d’un consensus formel sur les moyens thérapeutiques, le traitement est symptomatique et basé sur la réanimation hydro électrolytique, respiratoire et neurologique. Le pronostic est intimement lié à la gravité des atteintes respiratoires et neurologiques avec une mortalité de 5 à 15%.
Nous rapportons un cas d’embolie graisseuse post-traumatique survenue chez un patient de 32 ans pris en charge dans notre unité de réanimation.
The aim of this report was to discuss the diagnostic and treatment of post traumatic fat embolism syndrome (FES). This is an association of pulmonary and systemic manifestations following obstruction of capillaries by fat emboli. The physiopathology is not clearly understood, and results in two theories such as the Gauss’s theory. The first description of FES is from Von Bergmann in 1873. The incidence is estimated to 0,5 to 30%. Some nontraumatic etiologies have been reported. The positive diagnostic involves traumatism of long bones associated to the Gurd triad (petechiae, respiratory insufficiency and cerebral involvement). In the absence of a consensus the treatment is mainly symptomatic based on hydroelectrolytic, respiratory and neurologic resuscitation. The prognostic depends on the severity of respiratory and neurologic dysfunction, with a mortality of 5 to 15%.
We report a case of posttraumatic FES occurred in a 32 years old man admitted in our Intensive care unit.
Dr Joseph Koné. Service d’Anesthésie Réanimation- Hôpital Mère-Enfant «le Luxembourg», Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Introduction :
Le syndrome d’embolie graisseuse (SEG) un phénomène secondaire à une obstruction des vaisseaux pulmonaires et systémiques par des emboles graisseux.
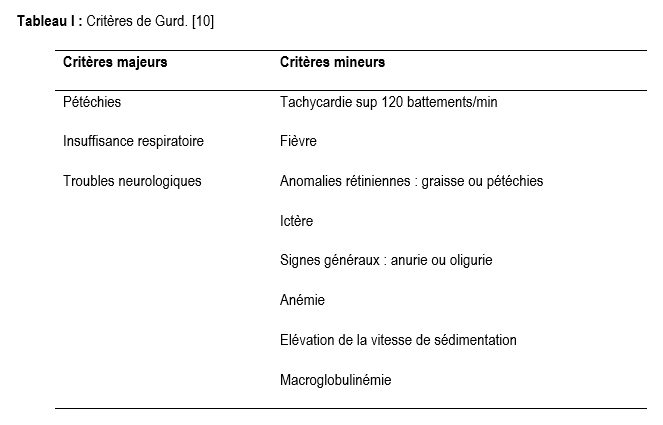
Depuis la première description du syndrome d’embolie graisseuse par Von Bergman en 1873,cette pathologie reste encore mal cernée tant sur le plan diagnostic que physiopathologique [1-3].La clinique n’est pas spécifique, autant que la biologie et la radiologie ; toutefois l’IRM permettrait une meilleure orientation de certitude avec cependant une sensibilité et une spécificité moindres [4-6]. Le lavage broncho alvéolaire, ou le cathétérisme de l'artère pulmonaire permettent une meilleure appréhension de la physiopathologie [7]. Sa fréquence est évaluée entre 0,5 à 30%, avec des facteurs favorisants comme les traumatismes des os longs [8]. La première autopsie réalisée par Zenker en 1862, montrant des emboles graisseux concernait des fractures de côtes [9].Dans sa physiopathologie complexe, deux théories sont émises dont celle de Gauss dite mécanique [2]. Les emboles proviendraient de la moelle osseuse, des graisses circulantes ou du tissu adipeux de réserve. La triade de Gurd(manifestations neurologiques, respiratoires et cutanés) survenant dans un contexte de traumatisme est évocatrice d’un SEG [2]. Le diagnostic positif est basé sur les critères de Gurd (Tableau I) [10].Il est retenu devant l'association d'un critère majeur et quatre critères mineurs ou bien de deux critères majeurs et deux critères mineurs à la suite d'un polytraumatisme ou d'un traumatisme des membres. La biologie révèle des troubles du bilan lipidique, une thrombopénie, une anémie, une perturbation du bilan rénal et de la gazométrie artérielle [3,8]. Le traitement est symptomatique et basé sur la réanimation respiratoire et neurologique [2,8]. Les thérapeutiques proposées comme la corticothérapie, l’héparinothérapie, l’alcool intraveineux, les colloïdes n’ont pas démontré d’efficacité formelle. La prévention reste capitale [11]. Les complications sont d’ordres respiratoires et neurologiques, dont la gravité conditionne le pronostic bien que favorable dans la majorité des cas, avec toutefois une mortalité estimée entre 1 et 5 % [2].
Dans l’objectif de rappeler l’éventualité de cette pathologie assez complexe avec beaucoup de controverses autant sur le plan de la clinique que de la prise en charge, les auteurs rapportent un cas de syndrome d’embolie graisseuse admis et pris en charge dans l’unité de soins intensifs de l’Hôpital Mère Enfant « le Luxembourg » de Bamako.
Observation :
Il s’agissait d’un patient de 32 ans, sans antécédents pathologiques particuliers, admis en unité de soins intensifs sur transfert à partir d’un centre de traumatologie, après une hospitalisation de 48 heures pour polytraumatisme par AVP. Les lésions initiales étaient composées de fractures multiples et complexes au niveau de l’humérus droit, du fémur gauche, et de la jambe gauche avec un délabrement tissulaire en regard du tibia, sans notion de défaillance hémodynamique, respiratoire ou neurologique. La prise en charge orthopédique avait consisté en un parage suivi d’une immobilisation des fractures dans l’attente d’un traitement chirurgical. Après un intervalle de temps libre de 48 heures, il a été noté l’apparition d’une sensation de torpeur, avec agitation, suivies par une tachypnée, et l’installation progressive de trouble de la conscience motivant l’évacuation vers une unité de réanimation.
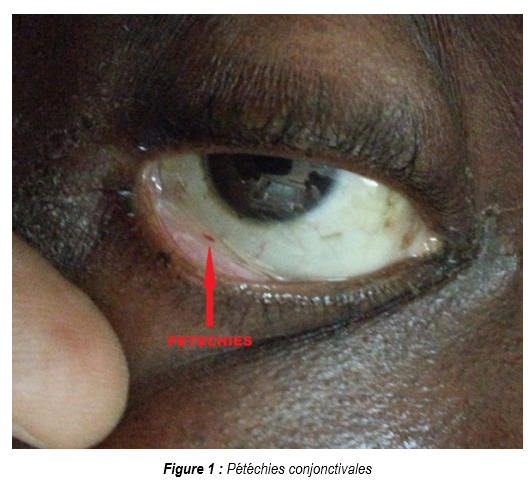
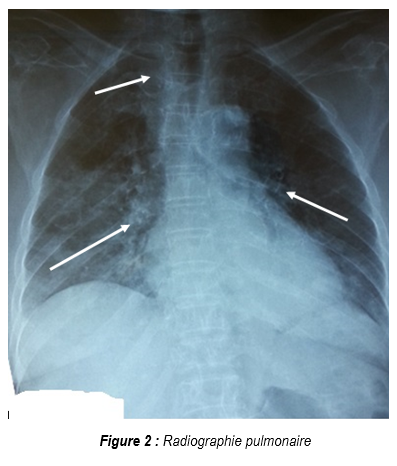
A l’admission en réanimation, l’examen physique retrouvait un patient polyfracturé, avec un score de Glasgow à 9, une température rectale à 38°1C, polypnéique (26 cycles par minute), un encombrement bronchique et une saturation périphérique en oxygène à 86% sous oxygène au masque à haute concentration. La pression artérielle était de 102/84mmHg avec une fréquence cardiaque de 129 battements par minute. L’auscultation retrouvait des râles crépitants diffus dans les deux champs pulmonaires prédominant aux bases. La réanimation initiale a consisté à une mise en condition avec aspiration bronchique et une intubation trachéale pour ventilation mécanique en mode ventilation assistée contrôlée (VAC), un équilibre hydro-électrolytique, suivie de la réalisation du bilan biologique et radiologique. Après stabilisation sur le plan hémodynamique et respiratoire, la poursuite de l’examen somatique retrouvait des conjonctives bien colorées avec des pétéchies (Figure 1), en plus des fractures des membres, dont une destruction musculaire importante au niveau de la jambe gauche. Aucun signe de traumatisme cranio-encéphalique (effraction cutanée, rhinorrhée, otorrhée) n’était visible. Le bilan biologique montrait un taux d’hémoglobine à 9,4g/dl, une thrombopénie à 98.000 plaquettes /mm³, une hyperleucocytose à 16.800 globules blancs /mm3, avec un taux de prothrombine à 65%, une CRP (C-Réactive Protéine) à 23mg/l. La goutte épaisse à la recherche de Plasmodium falciparum était négative. La radiographie pulmonaire objectivait : des opacités (infiltrats) parahiliaires et apicales bilatérales. La tomodensitométrie (TDM) cérébrale était normale.
Devant ce tableau, le diagnostic de syndrome d’embolie graisseuse a été discuté et retenu, en tenant compte du contexte, de la clinique et des résultats du bilan biologique et radiologique.
La prise en charge a comporté une corticothérapie à raison de 80 mg de méthylprednisolone donnés toutes les 6heures pendant 72 heures par voie intraveineuse directe, une thromboprophylaxie par énoxaparine à 40mg par voie sous cutané toutes les 24 heures et une transfusion de deux culots globulaires visant un taux d’hémoglobine supérieur à 10g/dl.
Le patient a bénéficié d’une fixation chirurgicale des foyers de fracture sous anesthésie générale. Une couverture antibiotique probabiliste à base d’amoxicilline+acide clavulanique en raison de 1gramme toutes les 08 heures a été instaurée en tenant compte du syndrome inflammatoire de réponse systémique (SIRS) et des potentielles portes d’entrées.
L’évolution s’est faite vers le réveil et l’extubation après 7 jours de ventilation mécanique en mode VAC suivi de la VS-PEP+AI (ventilation spontanée avec pression expiratoire positive et une aide inspiratoire). Le bilan clinique, radiologique et biologique de contrôle était sans particularité au transfert du patient en chirurgie au 9ème jour de son admission en réanimation.
Discussion :
Décrite depuis 1837, le syndrome d’embolie graisseuse reste encore mal compris aujourd’hui avec de nombreuses controverses autant sur le plan physiopathologique, diagnostic que thérapeutique [12]. Les formes mineures seraient sous diagnostiquées et seuls les cas avec dysfonction marquée d’organe font l’objet d’un diagnostic, et ceci en l’absence d’explication claire au tableau clinique du patient [13].
L’embolie graisseuse est fréquentedans les suites de fractures des os longs ou lors de la chirurgie orthopédique, passant inaperçue dans la majorité des cas en l’absence de manifestations clinique majeures. Seuls les patients présentant une dysfonction d’organes sont diagnostiqués. Il s’agit d’atteinte multiviscérale impliquant principalement les poumons, le cerveau et la peau constituant la triade classique du syndrome d’embolie graisseuse de Gurd. Le diagnostic est difficile en raison de l’absence de symptomatologie propre, et les troubles observés sont très souvent rattachables à d’autres étiologies plus évidentes dans le contexte post traumatique. Cependant le diagnostic positif repose sur les critères de Gurd (Tableau I) [10], il est évoqué devant un critère majeur et quatre critères mineurs ou l’association de deux critères majeurs et deux critères mineurs, dans un contexte de traumatisme des membres [3].
La survenue dans les 72 heures après traumatisme est régulièrement retrouvée. Notre patient avait observé un intervalle de temps libre de 48 heures avant l’installation de la symptomatologie respiratoire et neurologique. Cette notion d’intervalle libre de temps de longueur variable est caractéristique de ce syndrome [2].
L’occlusion des capillaires pulmonaires engendrée par les particules graisseuses est amplifiée par une agrégation de plaquettes et de fibrine. Les graisses circulantes sont ensuite hydrolysées par la lipoprotéine lipase pulmonaire avec libération systémique d’acides gras. Ces phénomènes sont à la base d’une toxicité tissulaire, expliquant l’installation d’un SIRS [2].
Chez notre patient, la présence de fractures osseuses multiples aurait occasionné une dissémination systémique de particules de moelle osseuse. La radiologie thoracique était évocatrice avec des lésions parahiliaires et apicales. Dans la littérature, la radiologie pulmonaire serait évolutive dans le temps passant par un temps de latence les 24 premières heures, suivies de l’installation d’un syndrome alvéolaire bilatéral vers la 48ème heure, se compliquant par des opacités micro nodulaires (Images en tempête de neige d’Allred). L’évolution peut se faire vers l’apparition d’un syndrome interstitiel bilatéral ou des images en verre dépoli [2].
Nous n’avons pas réalisé de lavage broncho alvéolaire qui aurait une spécificité plus élevée associée à l’échographie transœsophagienne et le cathétérisme de l’artère pulmonaire à la sonde Swan Ganz. Les pétéchies conjonctivales étaient mises en évidence chez notre patient, et ont disparu au 4ème jour de son admission en réanimation.
Des lésions rétiniennes hémorragiques au fond-d’œil ont été rapportées chez des patients admis pour SEG post traumatique [8]. Dans ce contexte du polytraumatisé, l’association de syndrome neurologique, détresse respiratoire et pétéchies conjonctivales pourrait faire discuter un syndrome de Perthes, éliminé par l’absence de cyanose cervico-faciale et la notion d’intervalle libre de tempsentre le traumatisme et les manifestations cliniques.
Les signes neurologiques sont de degrés divers, et seule l’IRM semble capable de révéler des lésions spécifiques d’ischémie par les emboles graisseux. Elombila M et al. rapportaient de multiples hypersignaux punctiformes à l’IRM réalisée chez un patient admis pour SEG post traumatique [6,14].La TDM cérébrale normale comme dans notre cas n’exclut pas le diagnostic [4]. Le diagnostic de lésions axonales diffuses est un diagnostic à éliminer devant un trouble de conscience à tomodensitométrie normale dans un contexte post-traumatique.
Il n’existe pas de test biologique, même si des signes classiques comme la thrombopénie,l’anémierégénérative et la dyslipidémie sont fréquemment rencontrés. La réanimation comporte la prise en charge de la détresse respiratoire pouvant requérir l’intubation trachéale et la mise sous ventilation mécanique, comme chez notre patient. Sur le plan neurologique, la lutte contre les agressions cérébrales secondaires d’origine systémique et l’équilibre hydro électrolytique sont indispensables.
L’héparinothérapie et la corticothérapie n’ont pas montré d’efficacité. Toute fois l’héparine de bas poids moléculaire reste indiquée dans la thromboprophylaxie ordinaire du patient hospitalisé à risque thrombotique indépendamment élevé tout en tenant compte de la thrombopénie et de l’atteinte de rénale classiquement décrites dans le syndrome d’embolie graisseuse. La transfusion est réputée « non fructueuse » comme dans toute anémie hémolytique ; cependant un taux d’hémoglobine de 10g/dl est un objectif transfusionnel recommandé chez le cérébro-lesé. L’atteinte rénale est prévenue par la réanimation hydro-électrolytique et le maintien d’une hématose correcte. La surveillance des désordres biologiques est capitale.
Dans les suites immédiates d’un traumatisme des os longs, il est recommandé de procéder à l’instauration d’une immobilisation précoce, d’une analgésie efficace, la restauration de la volémie et à la fixation chirurgicale des fractures.Dans les cas d'enclouage centromédullaire, la réalisation d’un trou transcortical de décompression après lavage abondant et sous pression afin d’éliminer diminuer la pression intramédullaire source de la dissémination d’emboles graisseux [2]. L’administration de corticoïde à but préventif reste suggérée (sans avoir prouvé à ce jour un avantage net). Un bolus de 120mg de méthylprednisolone est recommandé dès les premières heures du traumatisme, ainsi que l’assurance d’une oxygénothérapie et la surveillance de la saturation périphérique en oxygène SPO2 [11, 15,16].
L’évolution est bonne sous traitement précoce. Les complications respiratoires et neuro-encéphaliques font le pronostic intimement lié à la sévérité de la souffrance multiviscérale.
L’embolie graisseuse est responsable d’un syndrome complexe avec de nombreuses controverses concernant le diagnostic et les modalités thérapeutiques.
Conclusion :
Le syndrome d’embolie graisseuse post traumatique demeure une entité clinique dont le diagnostic repose sur un faisceau d’arguments cliniques, biologiques et radiologiques associés à un contexte évocateur. La prise en charge est symptomatique et comprend des mesures de réanimation principalement hydro-électrolytique, respiratoire et neurologique. La prévention est capitale devant les facteurs favorisants évoqués dans la littérature.
1. Von Bergmann E. A case of lethal fat embolism. Berlin Weekly Clinics 1873;10:385-388.
2. Mimoz O, Incagnoli P, Edouard A, Samii K. Le syndrome d'embolie graisseuse. Conférences d'actualisation; Paris: Elsevier; 1997.
3. Berdai AM, Shimi A, Khatouf M. Le syndrome d’embolie graisseuse post traumatique. The Pan African Medical Journal. 2014;17:83.
4. Kuo KH, Pan YJ, Lai YJ, Cheung WK, Chang FC, Jarosz J. Dynamic MR imaging patterns of cerebral fat embolism: a systematic review with illustrative cases. AJNR Am J Neuroradiol 2014;35:1052-7.
5. Liu HK, Chen WC. Images in clinical medicine. Fat embolism syndrome . N Engl J Med 2011 ; 364 : 1761.
6. David H, Rouquette I, Dubayle P, Goasdoue P, Boyer B, Pats B. IRM dans L'embolie graisseuse cérébrale post-traumatique. J Radiol. 1998;79(5):427–430.
7. Ketata W, Msaad S, Bahloul N, Marouen F, Ayoub A. Hémorragie intra-alvéolaire: présentation rare du syndrome d’embolie graisseuse. Revue des Maladies Respiratoires (2010), 27, 1109-1113.
8. David JS, Guillaume C, Gueugniaud PY. Embolie graisseuse. Prat Anesth Reanim 2006:291-5.
9. Zenker FA. Beiträgezurnormalen und pathologischen Anatomie der Lunge. Dresden: J Braunsdorf 1862:31.
10. Gurd AR, Wilson RI. The fat embolism syndrome. J Bone Joint Surg Br. 1974;56 (3):408–416.
11. Bederman SS, Bhandari M, McKee MD, Schemitsch EH. Do corticosteroids reduce the risk of fat embolism syndrome in patients with long-bone fractures? A meta-analysis. Can J Surg. 2009;52(5):386–393.
12. Nandi R, Venkategowda PM, Mutkule D, Rao SM. Fat embolism syndrome: Case report of a clinical conundrum. J Anaesthesiol Clin Pharmacol 2014;30:412-414.
13. Tzioupis CC, Giannoudis PV. Fat embolism syndrome: What have we learned over the years? Trauma 2011;13:259-81.
14. Elombila Marie, Moyikoua R, Monka M, Mawandza PD, Otiobanda GF. Syndrome d’embolie graisseuse post-traumatique : Cas clinique au Centre Hospitalier Universitaire de Brazzaville. Health Sci. Dis 2016 ; 17 (4) :91-94.
15. Habashi NM, Andrews PL, Scalea TM. Therapeutic aspects of fat embolism syndrome. Injury 2006;37(4):68-73.
16. Schonfeld SA, Ploysongsang Y, DiLisio R, Crissman JD, Miller E, Hammerschmidt DE. Fat embolism prophylaxis with corticosteroid. A prospective study in high-risk patients. Ann Int Med 1983;99:438-43.