Thrombose veineuse profonde des membres inférieurs en chirurgie générale au CHU Gabriel Toure au Mali
TRAORE Amadou1, KONATE Madiassa1, DIARRA Abdoulaye2, KONE Youssouf1, MAÏGA Amadou1, KONE Tany1, BAH Amadou1, SIDIBE Boubacar Yoro1, KELLY Boureima1, SAYE Zakari1, DOUMBIA Arouna Adama1, KAREMBE Boubacar1, SAMAKE Moussa1, DEMBELE Souleymane1, BAGAYOGO Drissa3, DIAKITE Ibrahim1, DEMBELE Bakary Tientigui1, TRAORE Alhassane1, KANTE Lassana1, TOGO Adégné1
1Service de chirurgie générale du CHU Gabriel Touré, Mali, 2 Service de chirurgie générale du CHU de Kati, Mali, 3 Service d’anesthésie-réanimation de l’Hôpital Mère-enfant « le Luxembourg », Mali.
La thrombose veineuse profonde du membre inférieur (TVPMI) est une pathologie grave de par ses complications dont la plus mortelle est l’embolie pulmonaire. L’objectif de ce travail était de déterminer la fréquence de la TVPMI en chirurgie générale, afin d’identifier les facteurs de risque et de déterminer les aspects diagnostiques, thérapeutiques et évolutifs.
Il s’agissait d’une étude rétrospective descriptive allant du 01 janvier 2010 au 31 décembre 2018 incluant tous les patients chez qui une TVPMI a été diagnostiquée à l’échographie doppler et, qui ont été pris en charge dans le service de chirurgie générale du CHU Gabriel Touré.
Sur 8720 patients hospitalisés, nous avons colligé 29 cas de thrombophlébite en 9 ans, soit une fréquence hospitalière de 0,33%. L’âge moyen était de 41,6 ± 20,19 ans. Le sex-ratio était de 0,5. Les antécédents retrouvés étaient le VIH et le diabète chez respectivement 6,9% et 3.4% des patients. Les facteurs de risque étaient : l’âge avancé (24,13%), le cancer (17,24%) et l’obésité (13,79%). La douleur a motivé la consultation dans 48,3% des cas. Les signes cliniques étaient : la fièvre (68,96%), la tachycardie (82,76%) le pouls grimpant de Mahler (82,76%), le signe de Homans positif (65,5%), la chaleur locale (44.8%), la rougeur (27,6%) et la circulation veineuse collatérale (10,3%). La thrombose veineuse concernait le membre inférieur gauche dans 72% et le membre inférieur droit dans 28%. Le thrombus était dans la veine poplitée chez 31% des patients. Tous nos patients ont reçu l’héparine de bas poids moléculaire et l’antivitamine K. L’évolution est marquée par de guérison sans séquelle chez 68,97% des patients et une embolie pulmonaire suivie du décès dans 10,3% des cas.
Conclusion : la TVPMI n’est pas rare dans notre contexte. Il ne semble se dégager aucune particularité clinique et diagnostique dans notre contexte. Cependant la mortalité par embolie pulmonaire reste élevée, ce qui suscite des interrogations sur la qualité de la prise en charge.
Lower limb Deep vein thrombosis (LLDVT) is a serious pathology due to its complications, the most fatal of which is pulmonary embolism. The objective of this work was to determine the frequency of LLDVT in general surgery, in order to identify the risk factors and to determine the diagnostic, therapeutic and outcomes aspects.
This was a descriptive retrospective study from January 01, 2010 to December 31, 2018 including all the patients in whom LLDVT was diagnosed by doppler ultrasound and who were treated in the general surgery department of Gabriel Touré Teaching Hospital.
Out of 8,720 hospitalized patients, we collected 29 cases (0,33%) of thrombophlebitis in 9 years. The mean age was 41.6 ± 20.19 years. The sex ratio was 0.5. The antecedents were HIV infection and diabetes in 6.9% and 3.4% respectively. The risk factors were: advanced age (24.13%), cancer (17.24%) and obesity (13.79%). Limb pain motivated the consultation in 48.3% of cases. The clinical signs were: fever (68.96%), tachycardia (82.76%), increasing Mahler's pulse (82.76%), positive Homans sign (65.5%), local heat (44.8%), redness (27.6%) and collateral venous circulation (10.3%). Venous thrombosis affected the left lower limb in 72% and the right lower limb in 28%. The thrombus was in the popliteal vein in 31% of patients. All of our patients received low molecular weight heparin and vitamin K antagonists. The outcomes are were healing without sequelae for 68.97% of patients and pulmonary embolism followed by death in 10.3% of cases.
Conclusion: LLDVT is common in our context. No clinical and diagnostic particularities seem to emerge in our study. However, mortality from pulmonary embolism remains high, which raises questions about the quality of treatment.
TRAORE Amadou, Service de chirurgie générale du CHU Gabriel Touré, FMOS, Bamako, Mali. Téléphone : +223 79 88 88 86. E-mail : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
INTRODUCTION
La thrombose veineuse profonde du membre inférieur (TVPMI) est une pathologie fréquente aussi bien en milieu chirurgical qu’en milieu médical. Elle constitue avec l’embolie pulmonaire (EP), la maladie thromboembolique veineuse (MTEV).
En Europe l’incidence annuelle de TVPMI varie entre 45 et 117 pour 100 000 habitants [1-3]. La plupart des études africaines sont réalisées dans les services médicaux. Ainsi, les études réalisées dans les services de cardiologies de Côte d’Ivoire, du Sénégal, du Mali et du Cameroun rapportent des fréquences hospitalières variant entre 0,4 à 3,1% [4-7].
La TVPMI est une pathologie grave de par sa complication potentiellement mortelle qui est l’embolie pulmonaire (EP). En France, la MTEV est responsable de 10000-20000 décès par an et constitue aux Etats unis d’Amérique la 3ème cause de mortalité [8 ; 9]. Il s’agit également d’une maladie récidivante qui peut évoluer vers le syndrome post-phlébitique.
Il s’agit d’une urgence diagnostique et thérapeutique. Le traitement associe les moyens mécaniques (la contention élastique et la surélévation des jambes) et les médicaments anticoagulants qui sont utilisés à dose curative durant au moins 3 mois [10].
Les études hospitalières en Afrique réalisées dans le milieu chirurgical sont rares. Ainsi cette étude a été initiée avec comme objectifs, de déterminer la fréquence de la TVPMI en chirurgie générale, d’identifier les facteurs de risque et de déterminer les aspects diagnostiques et thérapeutiques.
METHODOLOGIE
Il s’agissait d’une étude rétrospective descriptive allant du 01er janvier 2010 au 31 décembre 2018. Nous avons inclus tous les patients chez qui une TVPMI a été diagnostiquée à l’échographie doppler veineux et, qui ont été pris en charge dans le service de chirurgie générale du CHU Gabriel Touré. Les cas non confirmés par l’échodoppler et ceux avec des dossiers incomplets ont été exclus de l’étude.
Les données étudiées concernaient la fréquence hospitalière, l’âge, le sexe, les facteurs de risque, les signes cliniques et paracliniques, les traitements et les résultats du traitement.
RESULTATS
Pendant la période couverte par l’étude, nous avons prise en charge en hospitalisation 8720 patients dont 29 avaient une TVPMI soit une 0,33%. Elle représente 0,18% des consultations (29 sur 16295). Le nombre moyen de patient par année était de 4,14 ± 2,58 avec des extrêmes de 1 et 9 patients. L’âge moyen était de 41,6 ± 20,19 ans avec des extrêmes de 16 ans et 90 ans. Le sex-ratio était de 0,5.
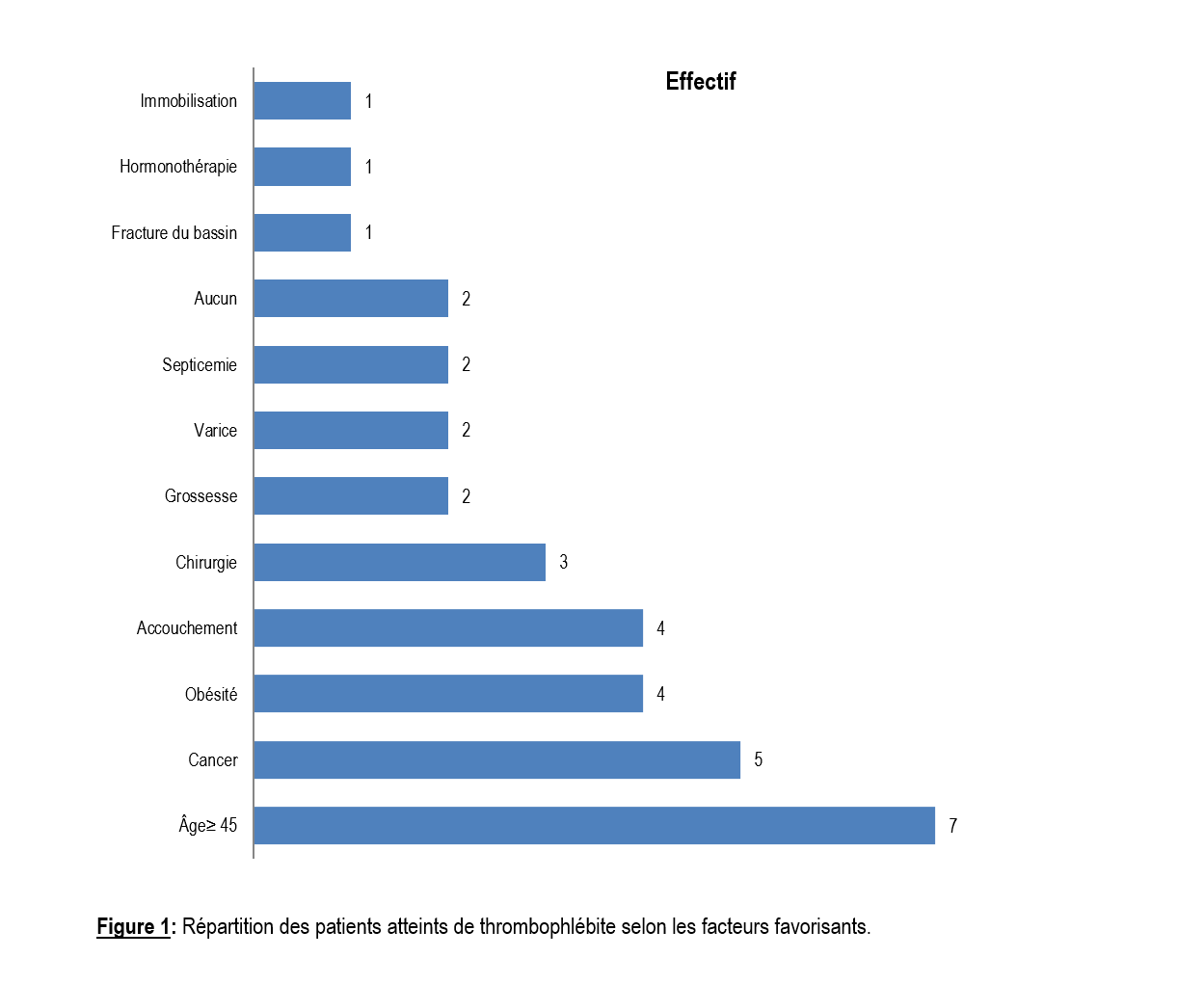
Les comorbidités retrouvées étaient le VIH (6,9%) et le diabète (3,4%). Les facteurs de risque favorisants les plus fréquents étaient l’âge avancé (≥ 45 ans), le cancer et l’obésité (Indice de Masse Corporelle (IMC) > 30 kg/m2) avec une fréquence respectivement de 24,13%, 17,24% et 13,79% (Figure 1).
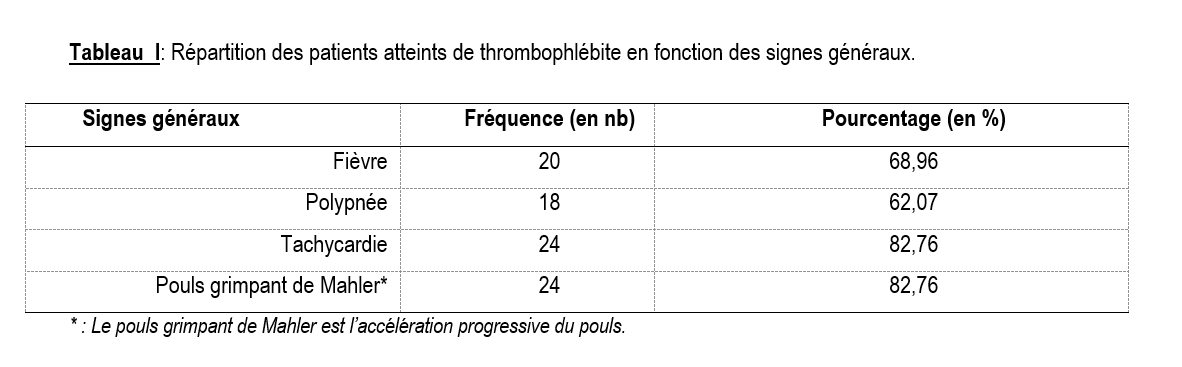
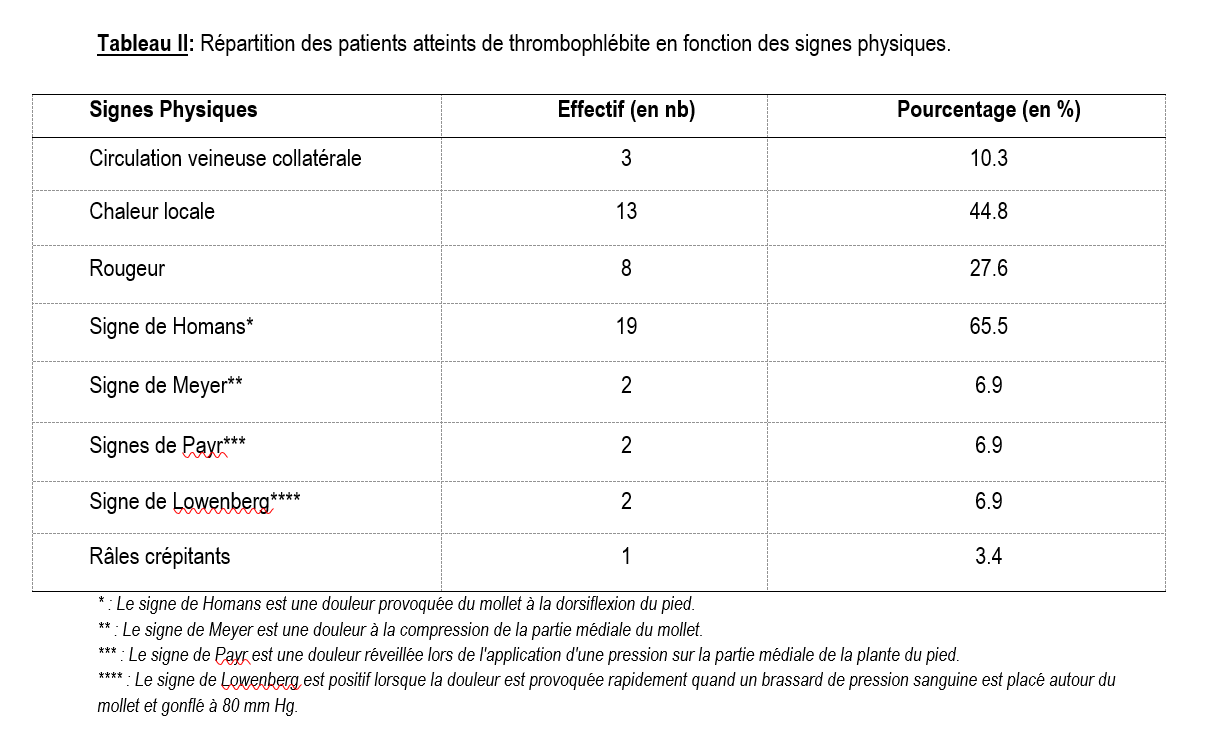
Tous les patients ont été hospitalisés pour suspicion de TVPMI. Le motif de consultation était la douleur (48,3%), la jambe œdématiée (44,8%) ou la fièvre (6,9%). Les principaux signes cliniques ayant fait évoquer la TVPMI étaient la fièvre (68,96%), la tachycardie (82,76%), le pouls grimpant de Mahler (82,76%), le signe de Homans positif (65,5%), la chaleur locale (44,8%), la rougeur locale (27,6%) et la circulation veineuse collatérale (10,3%) (Tableaux I et II). La vitesse de sédimentation était accélérée dans 58,6% des cas. Une hyperleucocytose (leucocytes > 10 000/mm3) et un taux d’hémoglobine bas (< 8g/dl) ont été retrouvés dans respectivement 31% et 51,7%. Le taux de plaquettes était élevé chez 9 patients cependant aucun patient n’a présenté de thrombopénie.
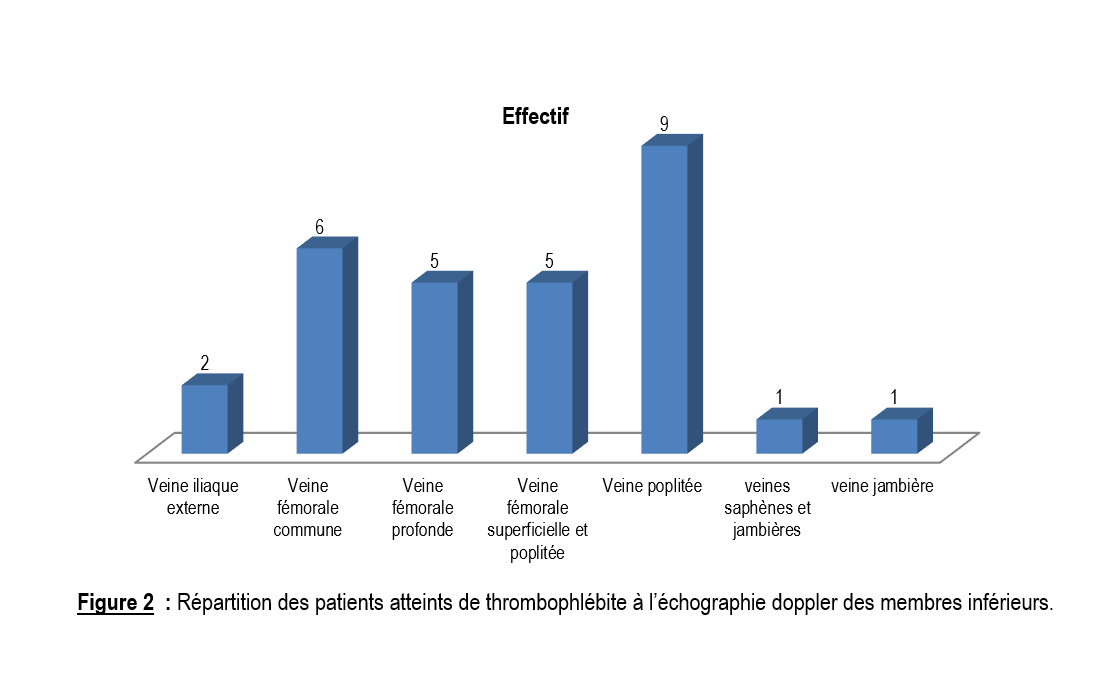
L’échographie doppler veineux des membres inférieurs a permis de confirmer le diagnostic chez tous nos patients. La thrombose veineuse concernait le membre inférieur gauche dans 72% et le MI droit dans 28%. Le thrombus était le plus souvent localisé dans la veine poplitée avec 31% (Figure 2).
Le traitement comportait les moyens mécaniques qui étaient le bandage élastique et la surélévation des jambes chez tous les patients. Le traitement médicamenteux associait l’héparinothérapie et l’antivitamine K en relais, chez tous les patients. La durée moyenne de traitement était de 3,45 mois avec des extrêmes de 2 jours à 6 mois.
L’évolution à 01 mois était marquée par 3 décès (10,3%) des suites d’embolie pulmonaire. A six mois, le taux de guérison sans séquelle était de 68,97% (20 patients) ; 06 patients étaient décédés des suites d’autres maladies (soit un total de 10 décès).
DISCUSSION
L’étude a permis dans un premier temps, d’aborder les aspects épidémiologiques de cette pathologie dans le service de chirurgie général. Ainsi, la TVPMI a été peu fréquente en milieu chirurgicale avec une fréquence de 0,33% des admissions. Ceci pourrait s’expliquer par le fait que la pathologie est prise en charge dans d’autres services médicaux comme : la cardiologie, la réanimation etc. En effet dans le service de cardiologie du CHU Gabriel Touré, Sangaré I en 2015, a rapporté 22 cas en 17 mois soit de 1,88% des admissions, ce qui est supérieur à notre résultat [11]. Dans les études réalisées en Afrique subsaharienne, la fréquence hospitalière varie de 0,4 à 3,1% [4,5,6,7,14].
L’âge est un des facteurs de risque les plus importants de la TVPMI et l’incidence annuelle de survenue d’un premier accident thromboembolique augmente de façon exponentielle à partir de 40 ans [1,3,18]. L’âge moyen dans notre étude était de 41,6± 20,19 ans. Ce résultat corrobore ceux rapportés par Sangaré en cardiologie au CHU Gabriel Touré (41ans) [11] ; Kingues au Cameroun (46 ans) et Chalal en Algérie (46,4 ans) [12 ; 13]. . Cette situation pourrait s’expliquer par la jeunesse de la population générale en Afrique. Mais des investigations complémentaires s’imposent pour mieux élucider cette tendance.
Les femmes ont été majoritaires dans notre étude de même que dans la plupart des études de la littérature [1, 2, 5, 7, 13, 14, 18]. Par contre Sangaré dont l’étude a été réalisée dans le même CHU a retrouvé une parité homme-femme [11]. L’incidence de la TVP serait plus élevée chez la femme en âge de procréer que chez l’homme de la même tranche d’âge à cause des facteurs propres au sexe féminin comme la contraception orale, la grossesse, l’accouchement [1,13].
Les principaux facteurs de risque de TVPMI retrouvés dans notre étude en dehors de l’âge étaient dans l’ordre de fréquence décroissante le cancer (5 cas), l’obésité (4 cas), l’accouchement (4 cas) et la chirurgie (3 cas). Les fréquences concernant les facteurs de risque varient dans la littérature. Nous n’avons pas trouvé de facteur de risque cardio-vasculaire ou pulmonaire probablement dû au fait que ces cas étaient pris en charge dans les services spécialisés dans le domaine. Les facteurs cardiovasculaires étaient majoritaires (54,43%) dans l’étude de Owono qui a été menée dans un service de cardiologie ; il s’agissait de l’obésité, l’hypertension artérielle, le diabète sucré et les cardiopathies [7]. Ils sont dominés dans l’étude de Kingue par : la chirurgie, les varices, des antécédents de thrombose veineuse profonde et l’obésité [12]. Dans l’étude de Chalal le facteur de risque le plus fréquent a été l’immobilité suivi par la chirurgie [13].
La chirurgie augmente de 20 fois le risque de MTEV lié au type et à la durée du geste opératoire, à la pathologie sous-jacente ou au terrain du patient [3,15]. Sans prophylaxie de routine, le taux de TVP chez les patients opérés en chirurgie générale varie de 15 à 40% [16].
La chirurgie a été la cause de TVP chez 10% de nos patients. Ce résultat n’est pas statistiquement différent de ceux des séries Algérienne et camerounaise [12,13] mais supérieures à celui rapporté par Dénakpo [17]. L’alitement est un facteur de risque non négligeable dans la survenue de la TVP surtout en période péri-opératoire. La connaissance de ces facteurs de risque notamment ceux en rapport avec le patient opéré, la pathologie chirurgicale, le geste opératoire et l’hospitalisation permettent de mettre un accent particulier sur la prophylaxie en milieu chirurgical.
La symptomatologie de la TVPMI est polymorphe [10]. Trois signes ont conduit à la découverte de la maladie chez nos patients : l’augmentation du volume du membre, la douleur et la fièvre. En plus de ces signes, le tableau clinique a été dominé par : la tachycardie, la fièvre, la chaleur locale, et le signe de Homans.
Dans l’étude de Sylla [14], la symptomatologie a été dominée par l’augmentation du volume du MI et la chaleur locale (85% des patients).
Devant des signes fortement évocateurs de TVP des MI, la réalisation d’un échodoppler veineux permet de confirmer le diagnostic avec une sensibilité et une spécificité proche de 100% pour les TVP proximales. L’échodoppler permet également de préciser la localisation de la thrombose [1,10,16].
L’atteinte du membre inférieur gauche a été la plus fréquente dans notre étude avec 72% des cas. Le même résultat a été rapporté dans la plupart des études de la littérature [5,11,13]. La raison pourrait être anatomique selon Chalal [13] ; la veine iliaque commune gauche passant derrière l’artère iliaque droite.
Le traitement curatif de la TVP des MI associe des moyens mécaniques et médicamenteux. La contention élastique et la surélévation des MI ont été réalisées chez tous nos patients.
Il ressort dans notre étude que 96,6% de nos patients ont reçu un traitement médicamenteux standard associant l’héparine de bas poids moléculaire (énoxaparine) et l’AVK (Acénocoumarol) en relais. Cette prise en charge a été insuffisante chez 3,4% des patients pour faute de moyens financiers. Le même protocole thérapeutique classique a été réalisé dans les études africaines [5,6,11,14]. Ce protocole a pour inconvénient de nécessiter une surveillance biologique rigoureuse et régulière (la numération des plaquettes pour l’HBPM et l’INR pour l’AVK). Le traitement médicamenteux bénéficie actuellement de l’introduction des anticoagulants oraux directs qui associent une efficacité équivalente à celle des AVK et une utilisation facilitée par l’absence de surveillance biologique régulière [10].
L’évolution immédiate a été marquée par la survenue d’embolie pulmonaire suivie de décès chez 10,3% des patients.
En effet, l’embolie pulmonaire est considérée comme la complication la plus grave de cette pathologie car elle est potentiellement mortelle. Il s’agit souvent dans notre contexte de patients démunis qui consultent tardivement et dont la prise en charge est difficile [6].
A six mois de suivi, le taux de guérison sans séquelle était de 68,97% (20 patients) ; 06 patients étaient décédés des suites d’autres maladies. Ces cas de décès étaient liés à l’évolution défavorable du cancer (3 cas), de la septicémie (2 cas) ou de la chirurgie (1 cas).
Sangaré [11] a rapporté un résultat similaire avec un taux de guérison sans séquelle de 68,18%, 13,6% de cas d’embolie pulmonaire. Par contre, la mortalité était plus faible (4,5%). Le taux de guérison était meilleur dans l’étude de Sylla [14] avec 82,5%. Diallo [6] a trouvé 12% de cas d’embolie pulmonaire compliquant la TVPMI.
Conclusion
La TVPMI n’est pas rare dans notre contexte. Le diagnostic repose surtout sur la clinique et l’échodoppler. Une prise en charge précoce et rigoureuse est nécessaire pour éviter une évolution dramatique. En milieu chirurgicale, un accent particulier doit être mis sur la prévention de cette pathologie et de ses complications.
1. Heit JA, Spencer FA, White RH. The epidemiology of venous thromboembolism. J Thromb Thrombolysis. 2016; 41: 3–14.
2. Oger E. Incidence of venous thromboembolism: a communuty-based study in western France. Thromb Haemost. 2000; 83(5): 657-60.
3. Fowkes FJ, Price JF, Fowkes FGR. Incidence of Diagnosed Deep Vein Thrombosis in the General Population: Systematic Review. Eur J Vasc Endovasc Surg. 2003; 25(1):1-5.
4. Assi E. Contribution à l’étude de la thrombose veineuse profonde chez le noir Africain. Abidjan : UFR des sciences médicales ; Thèse de médecine 2001, Abidjan, RCI.
5. Dioum M, Mbaye A, Ngaide AA, Leye M, Mingou JS, Gaye ND et al. Les thromboses veineuses des membres : aspects épidémiologiques, diagnostiques, thérapeutiques et évolutifs : étude rétrospective sur une période de 09 ans à propos de 148 cas colliges au service de cardiologie de l’Hôpital Général de Grand Yoff de Dakar. Rev. Cames Santé. 2017;5(1):79 – 82.
6. Diallo BA, Yena S, Diall IB, Diakite S, Sanogo K, Keita L, Ndirahisha E, Diakité M. Les phlébites des membres inférieurs en milieu hospitalo-universitaire malien. Ann. Afr. Thor. Cardiovasc. 2008 ; 3 (2) : 66-69.
7. Owono Etoudi P, Esiène A, Bengoni R, Amenale L, Afane A, Ela JZE : La MTEV : Aspects épidémiologies et facteurs de risque dans un hôpital Camerounais. Health Sciences And Diseases. 2015; 16(4)/1-4.
8. Bell WR. Pulmonary embolism: progress and problems. Am. J. Med. 1982; 72(2): 181-3.
9. Benatar SR, Immelman EJ, Jeffery P. Pulmonary embolism. Br. J. Dis Chest. 1986; 80(30): 313-34.
10. Galanaud J-P, Messas E, Blanchet-Deverly A, Quéré I, Wahl D, Pernod G. Prise en charge de la maladie thromboembolique veineuse en 2015. Rev Med Interne.2015;36 (11):746 – 52.
11. Sangaré I, Menta I, Ba HO, Fofana CA, Sidibé N, Sogodogo A, Sanogo KM. Thrombophlébite des membres dans le service de cardiologie du CHU Gabriel Touré. Mali Médical. 2015; 30 (1): 3 – 6.
12. Kingues S, Tagny-Zukam D, Binam F, Nouedoui C, Teyang A, Muna WFT. La maladie thromboembolique veineuse au Cameroun : à propos de 18 cas. Med Trop. 2002;62:47-50.
13. Chalal N, Demmouche A. Maladie thromboembolique veineuse dans la région de Sidi Bel Abbes, Algérie : Fréquence et facteurs de risque. Pan Africain médical journal. 2013 ; 16 : 45.
14. Sylla D, Sylla IS, Camara I, Kake A, Béavogui M, Doumbouya M et al. Thrombose veineuse profonde des membres inférieurs : A propos de 40 cas colligés à Conakry. Cardiologie Tropicale. 2017 ; 150 :1 – 5.
15. A Chandrakumar, AM Muhammed Sajid, TNK Suriyaprakash, KK Ajmal. Prevalence of venous thromboembolism risk factors and prophylactic adequacy among general surgical patients in a tertiary care hospital. Indian Heart Journal 68. 2016; 68: 513 – 8.
16. Geerts WH, Pineo GF, Heit JA, Bergqvist D, Lassen MR, Colwell CW, Ray JG. Prevention of Venous Thromboembolism. In: The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. CHEST 2004;126:338S–400S.
17. Denakpo JL, Zoumenou E, Kerekou A, Dossou F, Hounton N, Sambieni O, Massougbodji M. Fréquence et facteurs de risque de la maladie thromboembolique veineuse chez la femme en milieu hospitalier à Cotonou, Benin 2012. Médecine d’Afrique Noire 2012; 59(3):163-71.
18. Atılgan K, Demirdaş E, Er CZ, Çiçekçioğlu F. Evaluation of deep vein thrombosis incidence with respect to age and gender in light of regional factors in central Anatolia: A population-based study. J Surg Med. 2020;4(1):62-65.